Лекция 8 - Водородная и кислородная деполяризации
План лекции:
1. Катодные реакции при коррозии с водородной деполяризацией
2. Катодные реакции при коррозии с кислородной деполяризацией
1. Катодные реакции при коррозии
с водородной деполяризацией
В зависимости от электродного процесса, протекающего на катоде, различают несколько видов электрохимической коррозии. Во-первых, это коррозия при восстановлении ионов водорода на катоде (с водородной поляризацией). Такой вид катодного процесса возможен во всех типах коррозионных сред (нейтральных, щелочных, кислых), но чаще наблюдается в кислых средах при транспортировке и хранении кислот, травлении проката, кислотной очистке металлической поверхности.
Разряд ионов водорода на катоде представляют в виде схемы, состоящей из следующих стадий:
1. Диффузия и миграция гидратированных ионов водорода к катоду:
Н+·Н2О=(Н3О)+.
2. Дегидратация ионов водорода: (Н3О)+→Н+ + Н2О.
3. Вхождение иона водорода в состав двойного слоя.
4. Разряд иона водорода: Н+ + е– → Надс.
5. Рекомбинация атомов водорода в молекулу: Надс + Надс = Н2.
6. Образование и отрыв пузырьков из молекул водорода от поверхности электрода.
Термодинамическая вероятность такого процесса определяется таким условием:
равновесный потенциал ионизации металла ![]() в каждом случае должен быть отрицательнее равновесного потенциала реакции восстановления катионов водорода, т.е.
в каждом случае должен быть отрицательнее равновесного потенциала реакции восстановления катионов водорода, т.е. ![]()
![]() . Равновесный потенциал водородного электрода определяется активностью ионов водорода в растворе и согласно уравнению Нернста [для
стандартных условий 25°С и рН2=1,013∙105Па (1 атм)]:
. Равновесный потенциал водородного электрода определяется активностью ионов водорода в растворе и согласно уравнению Нернста [для
стандартных условий 25°С и рН2=1,013∙105Па (1 атм)]:
![]()
где 0,0592=2,3![]() ,
,
![]() , откуда
, откуда
![]() = – 0,0592 рН.
= – 0,0592 рН.
![]() > – 0,0592 рН — это условие термодинамической вероятности
процесса. Для рН7
> – 0,0592 рН — это условие термодинамической вероятности
процесса. Для рН7![]() = – 0,414 В, т. е. процесс возможен, если
= – 0,414 В, т. е. процесс возможен, если ![]() < – 0,414 В.
< – 0,414 В.
Коррозия с участием ионов водорода в кислотной среде при рН < 7
2H+ + 2e ↔ H2
или в нейтральной и щелочной среде при рН ≥ 7
2H2O + 2e ↔H2 + 2OH-
называется коррозией с выделением водорода или коррозией с водородной деполяризацией. Коррозия с водородной деполяризацией – это коррозия при восстановлении ионов водорода на катоде. Катодный процесс коррозии металлов с водородной деполяризацией в кислых средах включает следующие стадии:
1) диффузия и миграция гидратированных ионов водорода к катоду
H+ x Н2О = (H3О)+
2) дегидратация ионов водорода
(H3О)+→ H+ + Н2О
3) вхождение иона водорода в состав двойного слоя;
4) разряд иона водорода
H+ + e- → Hадс
5) рекомбинация атомов водорода в молекулу
Hадс+ Hадс= Н2
6) образование и отрыв пузырьков из молекул водорода от поверхности электрода.
Суммируя реакции, получим:
(H3О)+ + e- → ½ Н2 + Н2О
Коррозия металлов с водородной деполяризацией характеризуется:
• зависимостью скорости коррозии металла от рН раствора;
• зависимостью коррозионной стойкости сплавов от их природы и содержания в них катодных примесей;
• увеличением скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его растворения; • возможностью появления водородной хрупкости металлов.
Пример 1. В неокислительных кислотах – соляной, разбавленной серной – коррозия железа происходит с водородной деполяризацией. На рис. 8.1 представлена схема коррозии железа в растворе серной кислоты Н2SO4 с выделением водорода.
На анодных участках происходит процесс окисления металла
Fe → Fe2+ + 2e
На катодных участках протекают процессы восстановления, например, восстановление ионов водорода
2H+ + 2 e- → H2 (pH<7)
Медленной стадией электрохимического процесса восстановления водорода является восстановление гидратированных водородных ионов.
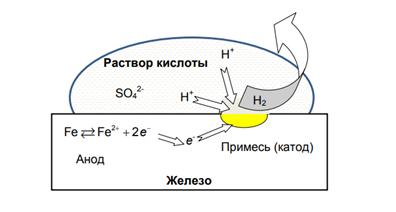
Пример коррозии железа в серной кислоте с водородной деполяризацией
При большой затрудненности реакции рекомбинации атомов водорода увеличивается возможность растворения ДЭС в металле с последующей диффузией водорода вглубь металла, что приводит к появлению водородной хрупкости.
Наблюдаются два вида повреждения металла водородом – водородная хрупкость и водородная коррозия. Часто эти явления накладываются друг на друга. При температуре выше 300°С на поверхности металла параллельно с реакцией обезуглероживания протекает процесс хемосорбции водорода и его распад на атомы. Проникая внутрь металла, атомы водорода образуют твердый раствор в железе, а также, частично, вступают в реакцию со свободными атомами углерода: С + 4Н = СН4.
Развивается высокое внутреннее давление и на поверхности металла появляются вздутия и трещины.
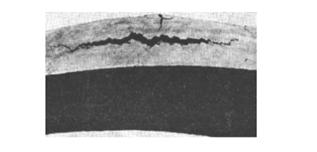
Водородное растрескивание стенки трубопровода
Процесс коррозии металла с водородной деполяризацией возможен, если:
EoMen+/Me < Е 2H+/H2 (при рН < 7)
или
EoMen+/Me < Е 2H2O/H2+2OH- (при рН ≥ 7).
2. Катодные реакции при коррозии
с кислородной деполяризацией
Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
Коррозии с кислородной деполяризацией подвергаются детали мостов, тоннелей, соприкасающиеся с водой и нейтральными водными растворами солей, подземные трубопроводы, днища резервуаров и др.
Процессы коррозии металлов, у которых на катодных участках осуществляется процесс восстановления (ионизация) кислорода, растворенного в электролите, называют процессами коррозии с кислородной деполяризацией.
Коррозия с участием молекул кислорода называется также коррозией с поглощением кислорода.
Катодный процесс коррозии металлов с кислородной деполяризацией включает следующие последовательные стадии:
1) растворение О2 в растворе электролита;
2) конвективную транспортировку растворенного кислорода в объеме раствора;
3) перенос кислорода внутри диффузионного слоя за счет молекулярной диффузии;
4) восстановление кислорода на корродирующей поверхности:
• в кислотной среде при рН < 7 O2 + 4H- + 4e- → 2H2O
• в нейтральной и щелочной среде при рН ≥ 7 O2 + 2H2O +4e-→ 4OH- ;
5) диффузионный и конвективный перенос ионов ОН− от катодных участков вглубь раствора.
Особенности протекания катодной реакции ионизации кислорода оказывают большое влияние на скорость коррозии металла. Вследствие незначительной растворимости кислорода в водных средах, как правило, замедленной стадией является перенос кислорода к поверхности металла в пределах диффузионного слоя.
Замедленность переноса кислорода к поверхности корродирующего металла обусловлена малой концентрацией кислорода в электролитах вследствие плохой его растворимости в воде и водных растворах, медленностью диффузии кислорода через слой электролита, прилегающий к поверхности корродирующего металла. Дополнительным затруднением диффузии кислорода является наличие пленки вторичных трудно растворимых продуктов коррозии.
Растворимость кислорода зависит от природы электролита и уменьшается при повышении концентрации растворенных солей. Кроме того, концентрация растворенного кислорода уменьшается при повышении температуры раствора и снижении парциального давления кислорода в газовой фазе.
Низкая растворимость кислорода в водных растворах определяет малые значения предельного диффузионного тока в условиях естественной конвекции. Одним из факторов, изменяющих эффективную толщину диффузионного слоя, является перемешивание раствора.
При достаточном содержании кислорода в водных средах на поверхности образуется защитная оксидная пленка, повышающая электродный потенциал металла.
Процесс коррозии металлов с кислородной деполяризацией возможен, если выполняется условие:
EoMen+/Me < Е O2 + 4H- /2H2O (при рН < 7)
или
EoMen+/Me < Е 2H2O +2O2/4OH- (при рН ≥ 7).