Лекция 7- Электродный потенциал
Для понимания механизма электрохимической коррозии необходимо установить, какие процессы наблюдаются на границе металл - раствор.
На границе двух соприкасающихся фаз при определенных условиях может возникнуть разность потенциалов или, как принято говорить, скачок потенциала, например, электродный потенциал – на границе металл-раствор.
Скачок потенциала между двумя фазами определяется переходом заряженных частиц из одной фазы в другую или избирательной адсорбцией заряженных или полярных частиц одной фазы на поверхности другой с образованием двойного электрического слоя.
Рассмотрим механизм возникновения электродного потенциала. Электродом называется металл, погруженный в раствор электролита.
Что же происходит на поверхности металла при погружении, например, его в раствор собственных ионов?
В металле и растворе имеются одинаковые ионы – ионы металла. В металле эти ионы находятся в узлах кристаллической решетки и удерживаются в ней благодаря энергии связи ионов решетки. Чтобы вывести ион из кристаллической решетки, необходимо затратить работу, равную энергии связи ионов, которую называют работой выхода иона из металла.
В водных растворах солей, щелочей, кислот взаимодействие ионов растворенного металла с диполями воды вызывается силами электростатического притяжения. Вследствие этого вокруг каждого иона в большей или меньшей степени (в зависимости от величины его заряда) образуется оболочка из диполей воды (явление гидратации). Таким образом, в растворе ионы металла окружены полярными молекулами воды, т.е. находятся в гидратированном состоянии (рис.).
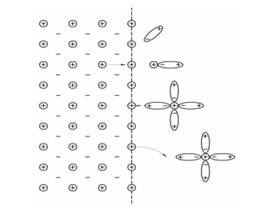
Схематическое изображение гидратации ионов металла при растворении
Чтобы вывести ион металла из раствора необходимо совершить работу, равную энергии гидратации, т. е. энергии связи иона металла с молекулами воды.
Установление электродного потенциала на металле зависит от соотношения энергии кристаллической решетки и энергии гидратации ионов.
Предположим, что на электроде протекает реакция, в которой окисленная форма О принимает n электронов и превращается в восстановленную форму R .
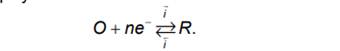
Эта же реакция, как мы уже видели, записывается и в другом виде:
![]()
Одновременно с процессом восстановления О до R идет обратный процесс окисления R до О.
При этом характерно участие одних и тех же веществ как в прямом, так и в обратном процессах переноса зарядов через границу фаз. Например, при анодной реакцией ионизации металла и в прямом, и в обратном процессах участвуют только катионы металла.
Из-за наличия электронов на поверхности металла ионы металла не могут удалиться вглубь раствора, а находятся у поверхности. Образуется двойной электрический слой (рис. 5.3, 5.4а).
Разность электрических потенциалов, возникающая на границе металл – раствор, вследствие избыточных зарядов, называется электродным потенциалом.
Схематически вид электрода записывается в виде Men+ /Me, a электродный потенциал электрода EMen+/Me Величина электродного потенциала определяется в вольтах (В).
При этом поверхность металла приобретает избыточный положительный заряд катионов, a оставшийся в приэлектродном пространстве избыток анионов сообщает ему отрицательный заряд. Положительный заряд поверхности металла затрудняет дальнейшее осаждение катионов и облегчает обратный процесс — переход ионов металла из решетки в раствор.
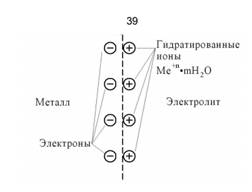
Двойной слой противоположных зарядов на поверхности металла при выходе иона из металла в раствор
В результате в системе устанавливается динамическое равновесие и возникает двойной электрический слой с противоположным распределением зарядов, т.е. поверхность металла заряжается положительно, а в растворе у поверхности металла образуется избыток анионов (рис. 5.4б).
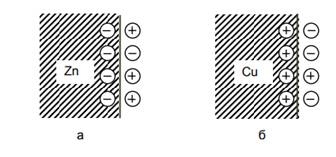
Двойной электрический слой системы: а – Zn | ZnSO4; б – Cu | CuSO4
Таким образом, независимо от энергетических соотношений, наступает динамическое равновесие между металлом и раствором его соли, которое характеризуется определенным по величине и знаку равновесным (обратимым) потенциалом. При равновесном потенциале, как уже было отмечено, плотность анодного тока равна плотности катодного тока и плотности тока обмена, которая характеризует скорость постоянного обмена ионами между металлом и раствором. При равновесном потенциале одновременно должны осуществляться два условия:
• на фазовой границе отсутствуют электрохимические и химические превращения;
• потенциал самопроизвольно переходит к одной и той же величине как от более высоких, так и от более низких его значений.
Абсолютные значения стандартных потенциалов определить экспериментально и вычислить теоретически не представляется возможным. В связи с этим их определяют, например, по отношению к стандартному водородному электроду, потенциал которого условно принят равным нулю.
УРАВНЕНИЕ НЕРНСТА И РАСЧЕТ ПОТЕНЦИАЛА ЭЛЕКТРОДА
Выведем выражение для ЭДС элемента в зависимости от концентраций, вступающих в реакцию и образующихся веществ.
В общем виде реакция в гальваническом элементе имеет вид:
pP +mM →qQ+ rR ,
где p моль вещества P плюс m моль вещества M реагируют с образованием q моль вещества Q, r моль вещества R и т.д.
Соответствующее изменение энергии Гиббса для реакции определяется по разности суммарной молярной энергии продуктов реакции и реагирующих веществ:
Δ G = (qGQ + rGR) –(pGP + mGM)
где GQ – молярная энергия Гиббса вещества Q и т.д.
Аналогичное выражение можно записать для каждого вещества в стандартном (произвольно выбранном) состоянии.
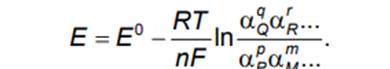
Это уравнение называется уравнением Нернста (1899 г.). Коэффициент активности αР растворенного вещества P равен его концентрации в моль на 1000 г воды (моляльности), умноженной на коэффициент активности.
Коэффициент активности зависит от температуры и концентрации. Если вещество P является газом, то его активность при обычных давлениях численно приблизительно равна давлению, выраженному в атмосферах. Активность чистого твердого вещества принята равной единице (αМе = 1). Активность воды также принята равной единице (αН2О = 1). Для отдельного электрода уравнения Нернста записываются с учетом следующих правил:
1) уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная;
2) в дробном индексе при E и E0 над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная;
3) активности твердых веществ в уравнение Нернста не входят.
Тогда согласно уравнению Нернста значения равновесных потенциалов катода и анода (ЕК и ЕА) связаны с активностью соответствующих ионов α уравнением (с использованием равенства ln 2,3lg x = x ):
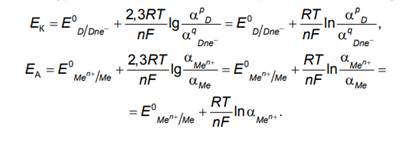
Уравнение (6.10) для металлического электрода, подставляя в которое значения констант: числа Фарадея F = 96500 Кл/моль, универсальной газовой постоянной R = 8,314 Дж/моль⋅К, температуры Т = = 298 К, преобразуется к виду:
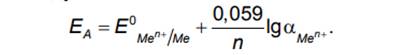
Если активность ионов в металле равна 1, второе слагаемое превращается в ноль и равновесный электродный потенциал становится равным стандартному. Таким образом, стандартный потенциал представляет собой частный случай равновесного потенциала.