Лекция 6- Теория электрохимической коррозии
План лекции:
1. Понятие электрохимической коррозии
2. Механизм электрохимической коррозии
1. Понятие электрохимической коррозии
Электрохимической коррозией называется самопроизвольный процесс разрушения металлов под действием электролитов, при котором окисление металла и восстановление окислителя протекают в виде двух сопряженных электрохимических процессов
Электрохимическая коррозия возникает при контакте металла с электролитом, а именно в жидких электролитах: влажных атмосфере и почве; морской и речной воде; водных растворах солей, щелочей и кислот. При электрохимической коррозии устанавливается коррозионный ток и происходит растворение металла вследствие электрохимического взаимодействия с электролитом.
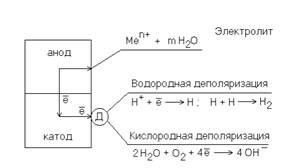
Схема электрохимической коррозии
Механизм электрохимической коррозии
Поверхность любого металла (сплава) в электролите электрохимии-чески гетерогенна (неоднородна), что приводит к образованию микрогаль-ванического коррозионного элемента и состоит из множества короткозамк-нутых микроэлектродных элементов.
Причины возникновения электрохимической неоднородности могут быть различными:
• неоднородность структуры металла (в углеродистых сталях присутствуют фазы – феррит и цементит, структурные составляющие – перлит, цементит и феррит, имеющие различные электродные потенциалы);
• наличие на поверхности сталей оксидных пленок, загрязнений, неметаллических включений;
• неравномерное распределение окислителя на границе «металл-электролит», например, различные влажность и аэрация на различных участках поверхности металла;
• неравномерность распределения температуры;
• контакт разнородных металлов.
Рассмотрим возникновение электрохимической коррозии на примере конструкционной стали.
Основным металлическим конструкционным материалов явядются углеродистые стали. Углеродистые (или черные) стали имеют в своем составе два компонента: железо (не менее 98,8%) и углерод (от 0,1 до 1,2 %). По назначению эти стали делятся на конструкционные (до 0.4%, содержания углерода), пружинно-рессорсные (0.5-0,6%), инструментальные (0.7-1.2%). Все остальные элементы в составе таких сталей (S, P,Si,N) содержатся в небольшом количестве и являются примесями.
В углеродистых сталях присутствую две азы – феррит (твердый раствор углерода в α-железе с растворимостью 0,02%) и цементит (соединения Fe3C с содержанием углерода 6,67?). Структурными составляющими являются: феррит, цементит и перлит (смесь феррита с цементитом).
Эта структура придает конструкционным сталям необходимые эксплуатационные и технологические свойства, такие как прочность, ковкость, свариваемость и пластичность. Одновременно с этим она же и способствует коррозии, так как все структурные составляющие углеродистых сталей имеют разные электродные потенциалы. Так же разница потенциалов возникает на границе зерен стали. Изучая структуру конструкционной стали подробнее, при ближайшем рассмотрении можно найти множество примеров коррозионных элементов (пар).
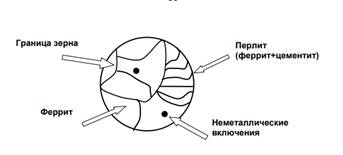
Структура углеродистой стали
Примеры пар коррозионных элементов
|
КАТОД |
АНОД |
|
Зерно |
Граница зерна |
|
Цементит |
Феррит |
|
Перлит |
Феррит |
|
Цементит |
Перлит |
|
Неметаллическое включение |
Феррит |
|
Зерно |
Микротрещина (края) |
При инициировании и развитии электрохимической коррозии одновременно протекают два электродных процесса.
2. Анодный и катодный процессы
1. Анодный — переход ионов металла в раствор с оставлением соответствующего числа электронов на поверхности металла:
Ме+е– + nН2О D Ме+ nН2О + е–.
Примерами таких процессов могут служить реакции окисления:
Zn D Zn2+ + 2е–
Al D Al3+ + 3е–
Fe2+ D Fe3+ + е–.
2. Катодный — ассимиляция избыточных электронов атомами или молекулами электролита (деполяризаторами), которые при этом восстанав-ливаются:
Ox + е– D Red,
где Ох — окислитель, присутствующий в растворе электролита;
Red — его восстановленная форма.
Примерами катодных процессов могут быть следующие реакции вос-становления:
Н+ + е– D 1/2 Н2
О2 + 2Н2О + 4е– D 4ОН–
Fe3+ + е– D Fe2+.
Анодный и катодный процессы протекают сопряженно и замедление одного из них тормозит другой. Как видно из приведенных реакций, разрушение (итог коррозии) металлов обычно наблюдают на аноде.
Анодный и катодный процессы классифицируются как первичные процессы коррозии, а продукты взаимодействия называют первичными продуктами коррозии.
В процессе электрохимической коррозии возможно протекание вторичных процессов: взаимодействие первичных продуктов коррозии друг с другом, электролитом, с растворимыми в нем газами с образованием вторичных продуктов коррозии. Наибольший интерес представляет образование пленок трудно-растворимых соединений (например, гидроксидов, фосфатов и др.). В общем случае слаборастворимые вторичные продукты коррозии затрудняют доступ электролита к поверхности металла и тем самым снижают скорость электрохимической коррозии.
При погружении металла в раствор электролита между поверхностью металла и электролитом возникает определенная разность потенциалов, что связано с образованием двойного электрического слоя, т. е. несимметричного распределения заряженных частиц на границе раздела фаз.
Пока коррозионный элемент разомкнут, на анодных и катодных участках реакции в прямом и обратном направлениях идут с одинаковой скоростью — обратимо. Обратимые электродные потенциалы металлов φобр зависят от характера электролита и температуры. Их рассчитывают по термодинамическим функциям.